Snemma morguns 29. desember birti NEJM nýja klíníska III. stigs rannsókn á nýju kínversku kórónuveirunni VV116 á netinu. Niðurstöðurnar sýndu að VV116 var ekki verra en Paxlovid (nematovir/ritonavir) hvað varðar batalengd og hafði færri aukaverkanir.
Myndheimild: NEJM
Miðgildi bata 4 dagar, tíðni aukaverkana 67,4%
VV116 er núkleósíðlyf til inntöku gegn nýju kórónaveirufaraldrinum (SARS-CoV-2), þróað í samstarfi við Junsit og Wang Shan Wang Shui, og er RdRp-hemill ásamt remdesivir frá Gilead, molnupiravir frá Merck Sharp & Dohme og azelvudine frá Real Biologics.
Árið 2021 lauk II. stigs klínískri rannsókn á VV116 í Úsbekistan. Niðurstöður rannsóknarinnar sýndu að VV116 hópurinn gat betur bætt klínísk einkenni og dregið verulega úr hættu á versnun í alvarlegt form og dauða samanborið við samanburðarhópinn. Byggt á jákvæðum niðurstöðum þessarar rannsóknar hefur VV116 verið samþykkt í Úsbekistan til meðferðar á sjúklingum með miðlungs til alvarlegt COVID-19 og er orðið fyrsta nýja lyfið til inntöku til kransæðasjúkdóma sem hefur verið samþykkt til markaðssetningar erlendis í Kína [1].
Þessi klíníska III. stigs rannsókn[2] (NCT05341609), undir forystu prófessors Zhao Ren frá Shanghai Ruijin-sjúkrahúsinu, prófessors Gaoyuan frá Shanghai Renji-sjúkrahúsinu og fræðimannsins Ning Guang frá Shanghai Ruijin-sjúkrahúsinu, lauk á meðan faraldurinn af völdum Omicron-afbrigðisins (B.1.1.529) geisaði frá mars til maí í Shanghai. Markmiðið var að meta virkni og öryggi VV116 samanborið við Paxlovid til snemmbúinnar meðferðar sjúklinga með væga til miðlungsmikla COVID-19. Markmiðið var að meta virkni og öryggi VV116 samanborið við Paxlovid til snemmbúinnar meðferðar sjúklinga með væga til miðlungsmikla COVID-19.
Myndheimild: Tilvísun 2
Fjölsetra, blindað, slembiraðað samanburðarrannsókn með 822 fullorðnum Covid-19 sjúklingum í mikilli hættu á versnun sjúkdómsins og með væg til miðlungi einkenni var framkvæmd á tímabilinu 4. apríl til 2. maí 2022 til að meta hæfi þátttakenda frá sjö sjúkrahúsum í Shanghai í Kína. Að lokum fengu 771 þátttakandi annað hvort VV116 (384 mg, 600 mg á 12 klst. fresti á degi 1 og 300 mg á 12 klst. fresti á dögum 2-5) eða Paxovid (387 mg, 300 mg af nimatuviri + 100 mg af ritonaviri á 12 klst. fresti í 5 daga) sem lyf til inntöku.
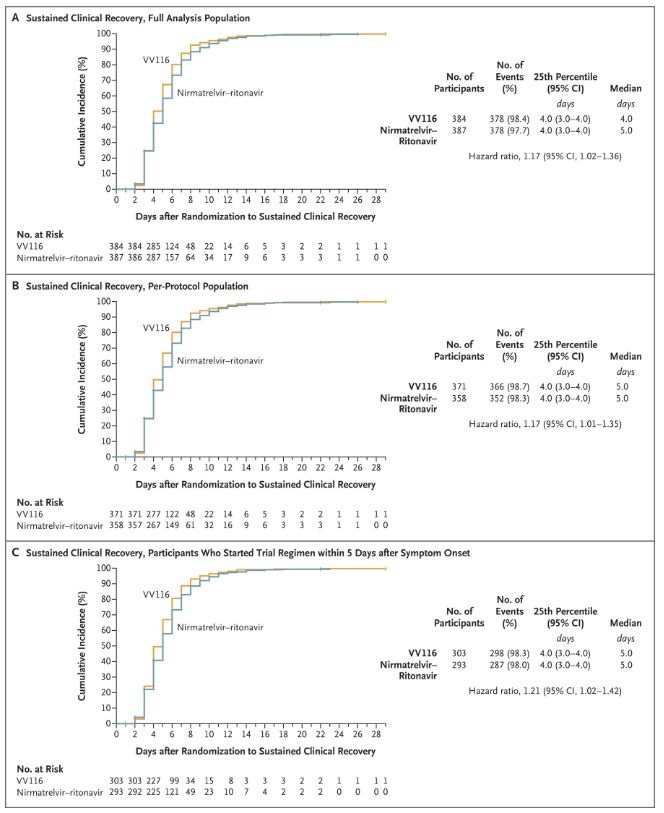
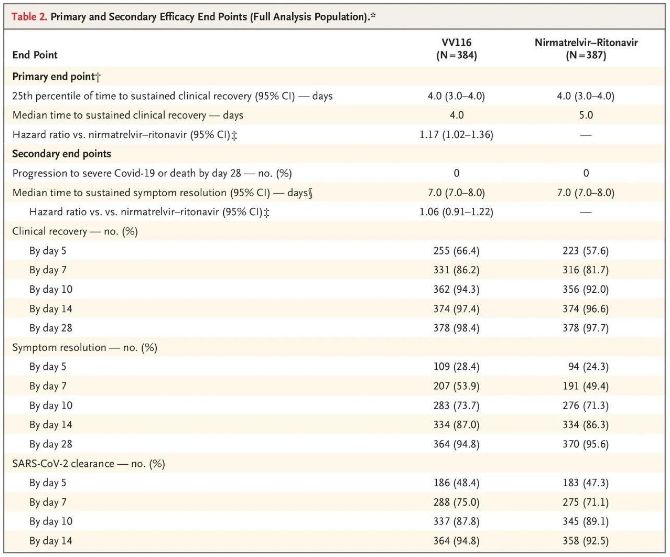
Niðurstöður þessarar klínísku rannsóknar sýndu að snemmbúin meðferð með VV116 við vægum til miðlungi alvarlegum COVID-19 sjúkdómi náði aðalendapunktinum (tími til viðvarandi klínísks bata) sem klínísk rannsóknaráætlun spáði fyrir um: miðgildi tíma til klínísks bata var 4 dagar í VV116 hópnum og 5 dagar í Paxlovid hópnum (áhættuhlutfall, 1,17; 95% öryggisbil, 1,02 til 1,36; neðri mörk >0,8).
Að viðhalda klínískum batatíma
Aðal- og aukaendapunktar virkni (ítarleg greining á þýðinu)
Myndheimild: Tilvísun 2
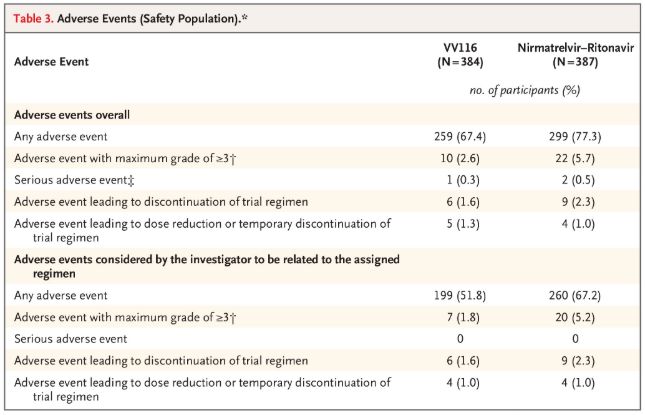
Hvað varðar öryggi greindu þátttakendur sem fengu VV116 frá færri aukaverkunum (67,4%) en þeir sem fengu Paxlovid (77,3%) við 28 daga eftirfylgni og tíðni aukaverkana af stigi 3/4 var lægri fyrir VV116 (2,6%) en fyrir Paxlovid (5,7%).
Aukaverkanir (öruggt fólk)
Myndheimild: Tilvísun 2
Deilur og spurningar
Þann 23. maí 2022 tilkynnti Juniper að klíníska skráningarrannsókn III. stigs á VV116 samanborið við PAXLOVID til snemmbúinnar meðferðar á vægum til miðlungi miklum COVID-19 sjúkdómi (NCT05341609) hefði náð aðalendapunkti rannsóknarinnar.
Myndheimild: Tilvísun 1
Þegar upplýsingar um rannsóknina vantaði voru deilurnar um III. stigs rannsóknina tvíþættar: í fyrsta lagi var þetta einblind rannsókn og í fjarveru lyfleysuviðmiðunar var óttast að erfitt yrði að meta lyfið fullkomlega hlutlægt; í öðru lagi voru spurningar um klínísku endapunktana.
Klínísk skilyrði fyrir þátttöku í Juniper eru (i) jákvæðar niðurstöður fyrir nýja krónuprófið, (ii) eitt eða fleiri væg eða miðlungi mikil COVID-19 einkenni og (iii) sjúklingar í mikilli hættu á alvarlegu COVID-19, þar á meðal dauða. Hins vegar er eini aðal klíníski endapunkturinn „tími til viðvarandi klínísks bata“.
Rétt fyrir tilkynninguna, þann 14. maí, hafði Juniper endurskoðað klínísku endapunktana með því að fjarlægja einn af klínísku aðalendapunktunum, „hlutfall umbreytinga í alvarleg veikindi eða dauða“ [3].
Myndheimild: Tilvísun 1
Þessi tvö meginágreiningsefni voru einnig sérstaklega fjallað um í birtri rannsókn.
Vegna skyndilegs útbreiðslu Omicron-veirunnar var framleiðslu á lyfleysutöflum fyrir Paxlovid ekki lokið fyrir upphaf rannsóknarinnar og því gátu rannsakendurnir ekki framkvæmt þessa rannsókn með tvíblindri, tvöfaldri eftirlíkingaraðferð. Hvað varðar einblindu hlið klínísku rannsóknarinnar sagði Juniper að aðferðin hefði verið framkvæmd eftir samskipti við eftirlitsaðila og að einblindu aðferðin þýddi að hvorki rannsakandinn (þar með talið matsmaður endapunkts rannsóknarinnar) né styrktaraðilinn muni vita nákvæma úthlutun lyfja fyrr en lokagagnagrunnurinn verður læstur að lokum rannsóknarinnar.
Þar til lokagreiningin fór fram hafði enginn þátttakenda í rannsókninni upplifað dauðsfall eða versnun í alvarlegt Covid-19 tilvik, þannig að engar ályktanir er hægt að draga um virkni VV116 við að koma í veg fyrir versnun í alvarlegt eða alvarlegt Covid-19 eða dauða. Gögnin bentu til þess að áætlaður miðgildi tíma frá slembiröðun til viðvarandi minnkunar á einkennum tengdum Covid-19 væri 7 dagar (95% öryggisbil, 7 til 8) í báðum hópum (áhættuhlutfall, 1,06; 95% öryggisbil, 0,91 til 1,22) [2]. Það er ekki erfitt að útskýra hvers vegna aðalendapunkturinn „tíðni umbreytingar í alvarleg veikindi eða dauða“, sem upphaflega var settur fyrir lok rannsóknarinnar, var fjarlægður.
Þann 18. maí 2022 birti tímaritið Emerging Microbes & Infections niðurstöður fyrstu klínísku rannsóknarinnar á VV116 hjá sjúklingum sem voru smitaðir af Omicron afbrigðinu [4], opinni, framsýnni hóprannsókn með 136 staðfestum sjúklingum sem voru inni á sjúkrahúsinu.
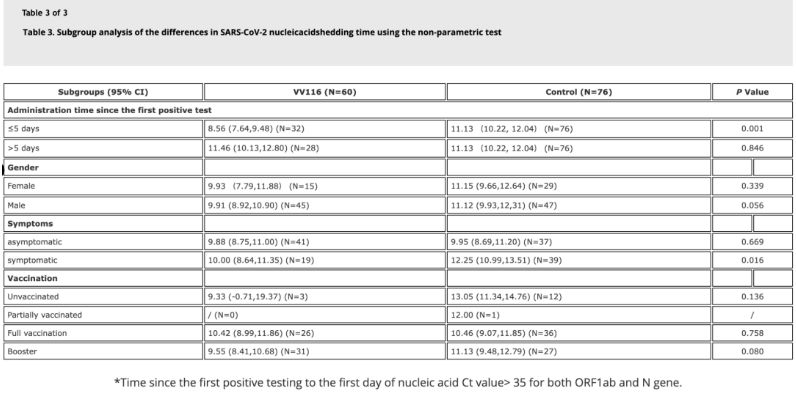
Gögn úr rannsókninni sýndu að hjá sjúklingum með Omicron sýkingu sem notuðu VV116 innan 5 daga frá fyrsta jákvæða kjarnsýruprófi var tími þar til kjarnsýrustig minnkaði 8,56 dagar, sem er styttri tími en í samanburðarhópnum sem var 11,13 dagar. Gjöf VV116 til sjúklinga með einkenni innan rannsóknartímans (2-10 dagar frá fyrsta jákvæða kjarnsýruprófi) stytti tímann þar til kjarnsýrustig minnkaði hjá öllum sjúklingum. Hvað varðar öryggi lyfsins komu engar alvarlegar aukaverkanir fram í VV116 meðferðarhópnum.
Myndheimild: Tilvísun 4
Þrjár klínískar rannsóknir eru í gangi á VV116, þar af tvær eru III. stigs rannsóknir á vægum til miðlungsmiklum COVID-19 sjúkdómi (NCT05242042, NCT05582629). Hin rannsóknin á miðlungsmiklum til alvarlegum COVID-19 sjúkdómi er alþjóðleg fjölsetra, slembiröðuð, tvíblind III. stigs klínísk rannsókn (NCT05279235) til að meta virkni og öryggi VV116 samanborið við hefðbundna meðferð. Samkvæmt tilkynningu frá Juniper var fyrsti sjúklingurinn skráður í lyfjameðferðina og gefinn skammtur í mars 2022.
Myndheimild: clinicaltrials.gov
Tilvísanir:
[1]Junshi Biotech: Tilkynning um aðalendapunkt skráðrar klínískrar rannsóknar í III. stigi á VV116 samanborið við PAXLOVID til snemmbúinnar meðferðar á vægum til miðlungi alvarlegum COVID-19 sjúkdómi.
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Jingwen Ai, Yi Zhengo, Jaianming Ga, Ha, Zhango, Jianming, Xingo Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Omicron sýkingarsnið og bólusetningarstaða meðal 1881 lifrarígræðsluþega: fjölsetra afturskyggn hópur. Emerging Microbes & Infections 11:1, bls. 2636-2644.
Birtingartími: 6. janúar 2023
 中文网站
中文网站